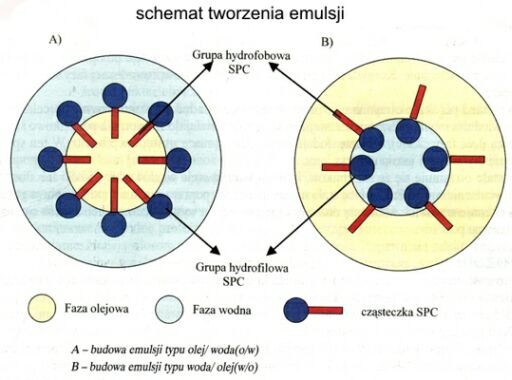
 Środki powierzchniowo czynne.
Środki powierzchniowo czynne.
Środki piorące są to substancje chemiczne, których wodne roztwory mają zdolność usuwania brudu z powierzchni różnych przedmiotów.
Zdolność tę przejawiają substancje, które obniżają napięcie powierzchniowe wody, dlatego nazywa się je substancjami (środkami) powierzchniowo czynnymi.
Wodne roztwory substancji powierzchniowo czynnych zwilżają powierzchnie pranych przedmiotów, mają zdolność wnikania w ich szczeliny i zagłębienia, otaczają cząstki brudu cienką warstwą, rozdrabniają je i zapobiegają powtórnemu osadzaniu się brudu na pranych przedmiotach.
Asortyment środków piorących jest bardzo liczny. Do podstawowych zalicza się mydła i syntetyczne środki piorące, zwane potocznie detergentami. Skuteczność działania środka piorącego zależy od wielu elementów, takich jak: rodzaj substancji powierzchniowo czynnej i jej zawartość w kąpieli piorącej, rodzaj zabrudzenia, twardość wody w kąpieli piorącej, działanie energii mechanicznej podczas prania, sposób kontaktu pranego materiału z kąpielą piorącą, rodzaj pranego materiału, temperatura prania i inne.
Twardość wody i jej wpływ na procesy prania i mycia.
Woda używana do prania powinna być miękka, a więc pozbawiona soli wapnia i magnezu. Wody o dużej zawartości tych soli nazywa się twardymi. Zależnie od rodzaju rozpuszczonych w wodzie soli wapnia i magnezu rozróżnia się twardość przemijającą (węglanową) i twardość trwałą (niewęglanową).
■ Twardość przemijającą wywołują rozpuszczone w wodzie wodorowęglany (tzw. kwaśne węglany) wapnia i magnezu, Ca(HCO3)2 i Mg(HCO3)2. Sole te rozkładają się w temperaturze powyżej 70°C, wytrącając trudno rozpuszczalne w wodzie węglany wapnia i magnezu (CaCO3 i MgCO3). W wyniku podgrzewania zawartość jonów wapnia i magnezu w wodzie spada i woda staje się bardziej miękka. Twardość przemijającą można więc usunąć przez zagotowanie wody. Gotowaniu takiej wody towarzyszy osadzanie się na powierzchni naczynia węglanów wapnia i magnezu, tworzących tzw. kamień kotłowy.
■ Twardość trwałą wywołują sole wapnia i magnezu, w postaci chlorków, siarczanów i azotanów, rozpuszczone w wodzie. Nie można jej usunąć przez zagotowanie wody.
Obydwa rodzaje twardości składają się na tzw. twardość ogólną wody.
Jednostką twardości wody zgodnie z Układem Jednostek i Miar SI jest milimol/dm3. Stosowaną powszechnie jednostką jest jednak nadal milival/dm3, a w praktyce często tzw. stopień niemiecki (°n). Wartość 1°n oznacza twardość wywołaną obecnością soli wapnia i magnezu, której odpowiada zawartość 10 mg tlenku wapnia (CaO) w 1 dm3 wody. Aby określić twardość w stopniach niemieckich należy przeliczyć zawartość odpowiedniej soli, powodującej twardość w 1 dm3 wody, na odpowiadającą tej zawartości ilość CaO.
Według stopni niemieckich wodę można klasyfikować pod względem twardości na:
— wodę bardzo miękką: od 0 do 4°n;
— wodę miękką: od 4 do 8°n;
— wodę średnio twardą: od 8 do 12°n;
— wodę dość twardą: od 12 do 18°n;
— wodę twardą: od 18 do 30°n;
— wodę bardzo twardą: powyżej 30°n.
Wartości 1 milivala/dm3 odpowiada w przybliżeniu twardość 2,8°n.
Do prania powinno się używać wody możliwie miękkiej, najlepiej bardzo miękkiej. W przyrodzie jedynie woda pochodząca z opadów atmosferycznych (deszczówka) jest wodą bardzo miękką. Stosowanie wody o zbyt dużej twardości powoduje, że rozpuszczone w niej sole wapnia i magnezu tworzą w reakcji z substancjami powierzchniowo czynnymi różnego rodzaju związki, które nie mają zdolności usuwania brudu i są przyczyną strat środka piorącego. Związki te mogą ponadto osadzać się na pranym materiale, powodując jego szarzenie lub żółknięcie. Przykładem produktów reakcji mydeł, stosowanych do mycia lub prania, z solami wapnia i magnezu powodującymi twardość wody, są mydła wapniowo-magnezowe. Mydła te są praktycznie nierozpuszczalne w wodzie i wytrącają się na pranym materiale w postaci szarego, mazistego osadu, zanieczyszczając go. Konsekwencją tego procesu są straty mydła, które w 100 dm3 wody wynoszą ok. 16 g mydła na każdy stopień niemiecki twardości.